植物细胞培养是在植物组织培养技术基础上发展起来的。1902年Haberlandt确定了植物的单个细胞内存在其生命体的全部能力(全能性),使成为植物组织培养的开端。其后,为了实现分裂组织的无限生长,对外植体的选择及培养基等方面进行了探索。20世纪30年代,组织培养取得了飞速的发展,细胞在植物体外生长成为可能。1939年Gautheret,Nobercourt,White分别成功地培养了烟草、萝卜的细胞,至此,植物组织培养才真正开始。50年代,Talecke和Nickell确立了植物细胞能够成功地生长在悬浮培养基中。自1956年Nic-kell和Routin第一个申请用植物组织细胞培养产生化学物质的专利以来,应用细胞培养生产有用的次生物质的研究取得了很大的进展。随着生物技术的发展,细胞原生质体融合技术使植物细胞的人工培养技术进入了一个新的更高的发展阶段。借助于微生物细胞培养的先进技术,大量培养植物细胞的技术日趋完善,并接近或达到工业生产的规模。
植物细胞培养技术广泛用于农业、医药、食品、化妆品、香料等生产上,据报道,全美国的药方中四分之一是含有来源于植物的药品。尽管通过植物细胞培养可以获得许多产品,但总的来说分为两类:初级代谢产物(包括细胞本身为产物)和次级代谢产物。目前,细胞本身作为最终产物并不经济。大规模培养植物细胞主要用于生产次级代谢产物。有些产物通过化学方法合成很不经济;有些产物其唯一来源只能是植物,而许多有价值的植物必须生长在热带或亚热带地区,还要受到其它自然条件(如干旱、疾病)和人为条件(如政策)的影响。最不能克服的是,有些植物从种植到收获要花几年时间,又根难选出高产植株,不能满足需要。因此,可以通过采用大规模植物细胞培养技术直接生产。例如,紫草宁(shikonvin)是典型的通过大规模培养植物细胞生产的产品。紫草宁既可作为染料又可入药,价值高达$4500/kg,但是紫草(dithospermum)需要生长2~3年,其紫草宁浓度才达到干重的1%~2%,远不能满足需要。而通过大规模培养紫草宁可在短时间内(3周左右)大量生产紫草宁(干重的14%左右)。由此可见,植物细胞培养技术应用于大规模有价值产品的生产具有巨大潜力。
一、植物细胞培养基的组成和制备
1、细胞培养基的组成
确定植物细胞工业规模培养的培养基是个重要而复杂的问题。首先植物细胞培养基较微生物培养基复杂得多,且工业化培养基又不同于实验室用培养基,即便是工业化培养本身,甚至因培养目的及培养阶段不同而采用不同培养基。植物细胞大规模培养目的是生产细胞、初级代谢产物、次级代谢产物、疫苗或用于生物转化,迄今虽有几种已知成分培养基为人们普遍采用,但不同培养基培养结果不同。因此,需要根据不同培养对象、培养目的及培养条件探索适宜培养基。选择培养基的基本原则是培养过程使细胞总体积倍增时间1天左右为宜,但适宜于细胞生长的培养基,不一定适合于生产次生代谢产物及其它目的,通常需根据培养目标设计相应培养基,如需生产次生代谢产物时,除选用促进细胞生长培养基外,尚需提高次生代谢成为产率的培养基,待细胞生长至静止期时用以生产次生代谢产物。Morris在长春花细胞悬浮培养过程,对培养基进行组合研究并考察其蛇根碱、阿玛碱及其它生物碱产量的变化,发现细胞生长阶段和产物生产阶段采用不同培养基,各种产物均有不同程度增加,说明不同培养阶段必需采用不同培养基;又如锦紫苏悬浮细胞培养,首先从15种培养基种筛选出迷失香酸产率高的B5培养基,经试验又向其中添加2,4-二甲基苯氧乙酸作为激素,再用于培养锦紫苏细胞,产物生成量提高40%;又将蔗糖浓度由2%提高到7%,产物量又明显提高,且产物积累量可达到干细胞量13-15%;因此,在培养的不同阶段采用不同培养基以促进细胞生长及其它目的,是十分重要的。
无论培养目标设计是针对细胞生长还是针对代谢产物的积累,其培养基主要由碳源、有机氮源、无机盐、植物生长激素、有机酸和一些复合物质组成。
(1)碳源 蔗糖或葡萄糖是常用的碳源,果糖比前二者差。其他的碳水化合物不适合作为单一的碳源。通常增加培养基中蔗糖的含量,可增加培养细胞的次生代谢产物量。
(2)有机氮源 通常采用的有机氮源有蛋白质水解物(包括酪蛋白质水解物)、谷氨酰胺或氨基酸混合物。有机氮源对细胞的初级培养的早期生长阶段有利。L-谷氨酰胺可代替或补充某种蛋白质水解物。
(3)无机盐类 对于不同的培养形式,无机盐的最佳浓度是不相同的。通常在培养基中无机盐的浓度应在25mmol左右。硝酸盐浓度一般采用25~40mmol/L,虽然硝酸盐可以单独成为无机氮源,但是加入铵盐对细胞生长有利。如果添加一些琥珀酸或其他有机酸,铵盐也能单独成为氮源。培养基中必须添加钾元素,其浓度为20mmol/L,磷、镁、钙和硫元素的浓度在1~3mmol/L之间。
(4)植物生长激素 大多数植物细胞培养基中都含有天然的和合成的植物生长激素。激素分成两类既生长素和分裂素。生长素在植物细胞和组织培养中可促使根的形成,最有效和最常用的有吲哚丁酸(IBA)、吲哚乙酸和奈乙酸。分裂素通常是腺嘌呤衍生物。使用最多的是6-苄氨基嘌呤(BA)和玉米素(Z)。分裂素和生长素通常一起使用,促使细胞分裂、生长。其使用量在0.1~10mg/L之间,根据不同细胞株而异。
(5)有机酸 加入丙酮酸或者三羧酸循环中间产物如柠檬酸、琥珀酸、苹果酸,能够保证植物细胞在以铵盐作为单一氮源的培养基上生长,并且耐受钾盐的能力至少提高到10mmol。三羧酸循环中间产物,同样能提高低接种量的细胞和原生质体的生长。
表14-3 常用植物细胞培养基的组成(mg/L)
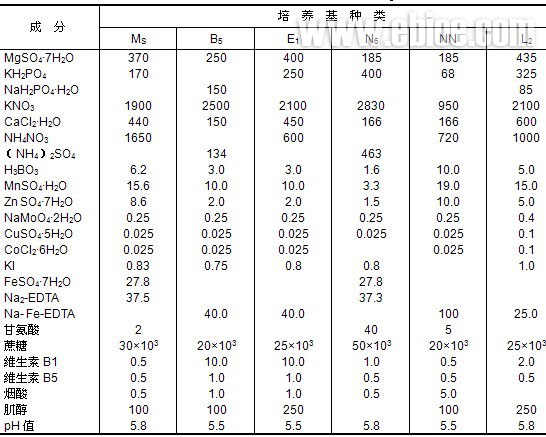
(6)复合物质通常作为细胞的生长调节剂如酵母抽提液、麦芽抽提液、椰子汁和水果汁。目前这些物质已被已知成分的营养物质所替代。在许多例子中还发现,有些抽提液对细胞有毒性。目前仍在广泛使用的是椰子汁,在培养基中浓度是1~15mmol/L。
目前应用最广泛的基础培养基主要有MS、B5、E1、N6、NN和L2等(表14-3)。
2、培养基的制备
培养基中使用的无机盐、碳源、维生素和生长激素应该采用高纯度级的药品。生长激素、2,4-D和NAA等在使用前需要重结晶提纯,其酒精一水溶液要用吸附法脱色处理。对于像2,4-D、IAA和NAA这样难溶于水的试剂,配溶液时可先溶于2~5ml酒精中,然后慢慢加入蒸馏水,稍微加热,稀释至所需体积,再调节pH。配制培养基应采用蒸馏水或者高纯度的去离子水。在培养基配制过程中可用0.5mol/L的HCl或0.2mol/LNaOH调节pH,固体培养基加入琼脂0.6%~1.0%,120℃蒸汽灭菌15~20min。对于一些热敏性化合物,应该用过滤法灭菌,如L-谷氨酰胺、植物生长激素、椰子汁等,然后再按无菌操作加入到已灭菌的培养基中。
由于培养基配比中有些组分量很小,种类又很多,配制起来很繁琐。因此往往把培养基配成使用浓度的10倍或者100倍的母液,分成小瓶后冷冻保存,使用时再稀释到正常浓度。经稀释后的培养基应放在10℃以下冰箱中保藏。为了防止在高浓度下培养基组分间相互作用产生沉淀,CaCl2、KI和EDTA钠铁盐等要单独配制保存,使用时再稀释混合。
>
二、植物细胞培养流程和方法
植物细胞培养与微生物细胞培养类似,可采用液体培养基进行悬浮培养。植物组织细胞的分离,一般采用次亚氯酸盐的稀溶液、福尔马林、酒精等消毒剂对植物体或种子进行灭菌消毒。种子消毒后在无菌状态下发芽,将其组织的一部分在半固体培养基上培养,随着细胞增殖形成不定形细胞团(愈伤组织),将此愈伤组织移入液体培养基振荡培养。如植物体也可采用同样方法将消毒后的组织片愈伤化,可用液体培养基振荡培养,愈伤化时间随植物种类和培养基条件而异,慢的需几周以上,一旦增殖开始,就可用反复继代培养加快细胞生殖。
继代培养可用试管或烧瓶等,大规模的悬浮培养可用传统的机械搅拌罐、气升式发酵罐。其流程见图14-6。
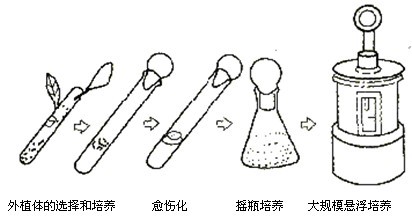
图14-6 植物细胞大规模培养流程
植物细胞培养系统可以粗略地分为固体培养和液体培养,每种培养方式又包括若干种方法,见图14-7。
三、植物细胞培养方法
植物细胞培养根据不同的方法可分为不同的类型。按培养对象可分为单倍体细胞培养和原生质体培养;按培养基可分为固体培养和液体培养;按培养方式又可分为悬浮培养和固定化细胞培养。
(1)单倍体细胞培养主要用花药在人工培养基上进行培养,可以从小孢子(雄性生殖细胞)直接发育成胚状体,然后长成单倍体植株;或者是通过组织诱导分化出芽和根,最终长成植株。
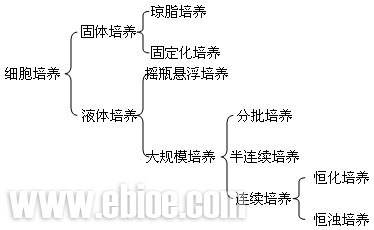
图14-7植物细胞的培养系统
(2)原生质体培养植物的体细胞(二倍体细胞)经过纤维素酶处理后可去掉细胞壁,获得的除去细胞壁的细胞称为原生质体。该原生质体在良好的无菌培养基中可以生长、分裂,最终可以长成植株。实际过程中,也可以用不同植物的原生质体进行融合与体细胞杂交,由此可获得细胞杂交的植株。
(3)固体培养固体培养是在微生物培养的基础上发展起来的植物细胞培养方法。固体培养基的凝固剂除去特殊研究外,几乎都使用琼脂,浓度一般为2%~3%,细胞在培养基表面生长。原生质体固体培养则需混入培养基内进行嵌合培养,或者使原生质体在固体-液体之间进行双相培养。
(4)液体培养液体培养也是在微生物培养的基础上发展起来的植物细胞培养方法。液体培养可分为静止培养和振荡培养等两类。静止培养不需要任何设备,适合于某些原生质体的培养。振荡培养需要摇床使培养物和培养基保持充分混合以利于气体交换。
(5)悬浮培养植物细胞的悬浮培养是一种使组织培养物分离或单细胞并不断扩增的方法。在进行细胞培养时,需要提供容易破裂的愈伤组织进行液体振荡培养,愈伤组织经过悬浮培养可以产生比较纯一的单细胞。用于悬浮培养的愈伤组织应该是易碎的,这样在液体培养条件下能获得分散的单细胞,而紧密不易碎的愈伤组织就不能达到上述目的。
(6)固定化培养固定化培养是在微生物和酶的固定化培养基础上发展起来的植物细胞培养方法。该法与固定化酶或微生物细胞类似,应用最广泛的,能够保持细胞活性的固定化方法是将细胞包埋于海藻酸盐或卡拉胶中。
四、植物细胞的大规模培养技术
目前用于植物细胞大规模培养的技术主要有植物细胞的大规模悬浮培养和植物细胞或原生质体的固定化培养。
(一)植物细胞的大规模悬浮培养
悬浮培养通常采用水平振荡摇床,可变速率为30~150r/min,振幅2~4cm,温度24~30℃。适合于愈伤组织培养的培养基不一定适合悬浮细胞培养。悬浮培养的关键就是要寻找适合于悬浮培养物快速生长,有利于细胞分散和保持分化再生能力的培养基。
1、悬浮培养中的植物细胞的特性
由于植物细胞有其自身的特性,尽管人们已经在各种微生物反应器中成功进行了植物细胞的培养,但是植物细胞培养过程的操作条件与微生物培养是不同的。与微生物细胞相比,植物细胞要大得多,其平均直径要比微生物细胞大30~100倍。同时植物细胞很少是以单一细胞形式悬浮存在,而通常是以细胞数在2~200之间,直径为2mm左右的非均相集合细胞团的方式存在。根据细胞系来源、培养基和培养时间的不同,这种细胞团通常由以下几种方式存在:①在细胞分裂后没有进行细胞分离;②在间歇培养过程中细胞处于对数生长后期时,开始分泌多糖和蛋白质;③以其他方式形成粘性表面,从而形成细胞团。当细胞密度高、粘性大时,容易产生混合和循环不良等问题。
由于植物细胞的生长速度慢,操作周期就很长,即使间歇操作也要2~3周,半连续或连续操作更是可长达2~3个月。同时由于植物细胞培养培养基的营养成分丰富而复杂,很适合于真菌的生长。因此,在植物细胞培养过程中,保持无菌是相当重要的。
2、植物细胞培养液的流变特性
由于植物细胞常常趋于成团,且不少细胞在培养过程中容易产生粘多糖等物质,使氧传递速率降低,影响了细胞的生长。对于植物细胞培养液的流变特性的认识目前还是很肤浅的,人们常用粘度这一参数来描述培养液的流变学特征。培养过程中培养液的粘度一方面由细胞本身和细胞分泌物等存在,另一方面还依赖于细胞年龄、形态和细胞团的大小。在相同的浓度下,大细胞团的培养液的表观粘度明显大于小细胞团的培养液的表观粘度。
3、植物细胞培养过程中的氧传递
所有的植物细胞都是好气性的,需要连续不断地供氧。由于植物细胞培养时对溶氧的变化非常敏感,太高或太低均会对培养过程产生不良地影响,因此,大规模植物细胞培养对供氧和尾气氧的监控十分重要。与微生物培养过程相反,植物细胞培养过程并不需要高的气液传质速率,而是要控制供氧量,以保持较低的溶氧水平。
氧气从气相到细胞表面的传递是植物细胞培养中的一个基本问题。大多数情况下,氧气的传递与通气速率、混合程度、气液界面面积、培养液的流变学特性等有关,而氧的吸收却与反应器的类型、细胞生长速率、pH值、温度、营养组成以及细胞的浓度等有关。通常也用体积氧传递系数(KLa)来表示氧的传递,事实证明体积氧传递系数能明显地影响植物细胞的生长。
培养液中通气水平和溶氧浓度也能影响到植物细胞的生长。长春花细胞培养时,当通气量从0.25L/(L·min)上升至0.38L/(L·min)时,细胞的相对生长速率可从0.34d-1上升至0.41d-1;而当通气量再增加时,细胞的生长速率反而会下降。曾在不同氧浓度时对毛地黄细胞进行了培养,当培养基中氧浓度从10%饱和度升至30%饱和度时,细胞的生长速率从0.15d-1升至0.20d-1,如果溶氧浓度继续上升至40%饱和度时,细胞的生长速率却反而降至0.17d-1。这就说明过高的通气量对植物细胞的生长是不利的,会导致生物量的减少,这一现象很可能是高通气量导致反应器内流体动力学发生变化的结果,也可能是由于培养液中溶氧水平较高,以至于代谢活力受阻。
由上述情况可以看出,氧对植物细胞的生长来说是很重要的,但是C02的含量水平对细胞的生长同样相当重要。研究发现,植物细胞能非光合地固定一定浓度的C02,如在空气中混以2%~4%的C02能够消除高通气量对长春花细胞生长和次级代谢物产率的影响。因此,对植物细胞培养来说,在要求培养液充分混合的同时,C02和氧气的浓度只有达到某一平衡时,才会很好地生长,所以植物细胞培养有时需要通入一定量的C02气体。
4、泡沫和表面粘附性
植物细胞培养过程中产生泡沫的特性与微生物细胞培养产生的泡沫是不同的。植物细胞培养过程中产生的气泡比微生物培养系统中气泡大,且被蛋白质或粘多糖覆盖,因而粘性大,细胞极易被包埋于泡沫中,造成非均相的培养。尽管泡沫对于植物细胞来说,其危害性没有微生物细胞那么严重,但如果不加以控制,随着泡沫和细胞的积累,也会对培养系统的稳定性产生很大的影响。
5、悬浮细胞的生长与增殖
由于悬浮培养具有三个基本优点:①增加培养细胞与培养液的接触面,改善营养供应;②可带走培养物产生的有害代谢产物,避免有害代谢产物局部浓度过高等问题;③保证氧的充分供给。因此,悬浮培养细胞的生长条件比固体培养有很大的改善。
悬浮培养时细胞的生长曲线如图14-8所示,细胞数量随时间变化曲线呈现S形。在细胞接种到培养基中最初的时间内细胞很少分裂,经历一个延滞期后进入对数生长期和细胞迅速增殖的直线生长期,接着是细胞增殖减慢的减慢期和停止生长的静止期。整个周期经历时间的长短因植物种类和起始培养细胞密度的不同而不同。在植物细胞培养过程中,一般在静止期或静止期前后进行继代培养,具体时间可根据静止期细胞活力的变化而定。

图14-8悬浮培养时细胞的生长曲线
6、细胞团和愈伤组织的再形成和植株的再生
悬浮培养的单个细胞在3~5d内即可见细胞分裂,经过一星期左右的培养,单个细胞和小的聚集体不断分裂而形成肉眼可见的小细胞团。大约培养两周后,将细胞分裂再形成的小愈伤组织团块及时转移到分化培养基上,连续光照,三星期后可分化成试管苗。
(二)植物细胞或原生质体的固定化培养
经过多年的研究发现,与悬浮培养相比,固定化培养具有很多优点:(1)提高了次生物质的合成、积累;(2)能长时间保持细胞活力;(3)可以反复使用;(4)抗剪切能力强;(5)耐受有毒前体的浓度高;(6)遗传性状较稳定;(7)后处理难度小;(8)更好的光合作用;(9)促进或改变产物的释放。
1979年,Brodelius首次将高等植物细胞固定化培养以获得目的次级代谢产物,此后,植物细胞的固定化培养得到不断的发展,逐步显示其优势。不完全统计,约有50多种植物细胞已成功地进行了固定化培养.
植物细胞的固定化常采用海藻酸盐、卡拉胶、琼脂糖和琼脂材料,均采用包埋法,其他方式的固定化植物细胞很少使用。
原生质体比完整的细胞更脆弱,因此,只能采用最温和的固定化方法进行固定化,通常也是用海藻酸盐、卡拉胶和琼脂糖进行固定化。
五、影响植物细胞培养的因素
植物细胞生长和产物合成动力学也可分为三种类型:①生长偶联型,产物的合成与细胞的生长呈正比;②中间型,产物仅在细胞生长一段时间后才能合成,但细胞生长停止时,产物合成也停止;③非生长偶联型,产物只有在细胞生长停止时才能合成。事实上,由于细胞培养过程较复杂,细胞生长和次级代谢物的合成很少符合以上模式,特别是在较大的细胞群体中,由于各细胞所处的生理阶段不同,细胞生长和产物合成也许是群体中部分细胞代谢的结果。此外,不同的环境条件对产物合成的动力学也有很大的影响。
1、细胞的遗传特性
从理论上讲,所有的植物细胞都可看做是一个有机体,具有构成一个完整植物的全部遗传信息。在生化特征上,单个细胞也具有产生其亲本所能产生的次生代谢物的遗传基础和生理功能。但是,这一概念决不能与个别植株的组织部位相混淆,因为某些组织部位所具有的高含量的次生代谢物并不一定就是该部位合成的,而有可能是在其他部位合成后通过运输在该部位上积累的。有的植物在某一部位合成了某一产物的直接前体而转运到另一部位,通过该部位上的酶或其他因子转化。如尼古丁是在烟草根部细胞内合成后输送到叶部细胞内的,另外有些次生物在植物某一部位形成中间体,然后再转移另一部位经酶转化而成。因此,在进行植物细胞的培养时,必须弄清楚产物的合成部位。同时,在注意到整体植物的遗传性时,还必须考虑到各种不同的细胞。
细胞种质影响
2、培养环境
由于各类代谢产物是在代谢过程的不同阶段产生的,因此通过植物细胞培养进行次生代谢产物生产所受的限制因子是比较复杂的。各种影响代谢过程的因素都可能对它们发生影响,这些因素主要有光、温度、搅拌、通气、营养、pH值、前体和调节因子等。
(1)温度植物细胞培养通常是在25℃左右进行的,因此一般来说在进行植物细胞培养时很少考虑温度对培养影响。但是实际上,无论是细胞培养物的生长或是次生代谢物的合成和积累,温度都是起着一定的作用,需要引起一定的重视。
(2)pH值植物细胞培养的最适pH值一般在5~6。但由于在培养过程中,培养基的pH值可能有很大的变化,对培养物的生长和次生代谢产物的积累十分不利,因此需要不断调节培养液的pH值,以满足细胞的生长和产物代谢、积累的需要。
(3)营养成分尽管植物细胞能在简单的合成培养基生长,但营养成分对植物细胞培养和次生代谢产物的生成仍有很大的影响。营养成分一方面要满足植物细胞的生生长所需,另一方面要使每个细胞都能合成和积累次生代谢产物。普通的培养基主要是为了促进细胞生长而设计的,它对次生代谢产物的产生并不一定最合适。一般地说增加氮、磷和钾的含量会使细胞的生长加快,增加培养基中的蔗糖含量可以增加细胞培养物的次生代谢物。
(4)光光照时间的长短、光的强度对次生代谢产物的合成都具有一定的作用。一般来说愈伤组织和细胞生长不需要光照,但是光对细胞代谢产物的合成有很重要的影响。有人研究了光对黄酮化合物形成的影响,结果表明,培养物在光照特别是紫外光下黄酮及黄酮类醇糖苷积累的所有酶活性均增加。通常光照采用荧光灯,或者荧光灯和白炽灯混合,其光强度是300~10000lx(6~100μm/m2·s)可以连续光照,也可以每天光照12~18h。
(5)搅拌和通气植物细胞在培养过程中需要通入无菌空气,适当控制搅拌程度和通气量。在悬浮培养中更要如此。在烟草细胞培养中发现,如果KLa≤5h-1。,对生物产量有明显抑制作用。当KLa=5~10h-1,初始的KLa和生物产量之间有线性关系。当然不同的细胞系,对氧的需求量是不相同的。为了加强气-液-固之间的传质,细胞悬浮培养时,需要搅动。植物细胞虽然有较硬的细胞壁,但是细胞壁很脆,对搅拌的剪切力很敏感,在摇瓶培养时,摇瓶机振荡范围在100~150r/min。由于摇瓶培养细胞受到剪切比较小,因此植物细胞很适合在此环境生长。实验室中采用六平叶涡轮搅拌桨反应器培养植物细胞,由于剪切太剧烈,细胞会自溶,次生代谢产物合成会降低。各种植物细胞耐剪切的能力不尽相同,细胞越老遭受的破坏也越大。烟草的细胞和长春花的细胞在涡轮搅拌器转速150r/min和300r/min时,一般还能保持生长。培养鸡眼藤的细胞时,涡轮搅拌器的转速应低于20r/min。因此培养植物细胞,气升式反应器更为合适。
(6)前体在植物细胞的培养过程中,有时培养细胞不能很理想地把所需的代谢产物按所想像的得率进行合成,其中一个可能的原因就是缺少合成这种代谢物所必须的前体,此时如在培养物中加入外源前体将会使目的产物产量增加。因此,在植物细胞培养过程中,选择适当的前体是相当重要的。对于所选择的前体除了有增加产物产量的外,还要求是无毒和廉价。但是,寻找能使目的产物含量增加最有效的前体是有一定难度的。
虽然前体的作用在植物细胞培养中未完全清楚,可能是外源前体激发了细胞中特定酶的作用,促使次生代谢产物量的增加。有人在三角叶薯蓣细胞培养液中加人100mg/L胆甾醇,可使次生代谢产物薯蓣皂甙配基产量增加一倍。在紫草细胞培养中加入L-苯丙氨酸使右旋紫草素产量增加三倍。在雷公藤细胞培养中加入萜烯类化合物中的一个中间体,可使雷公藤羟内酯产量增加三倍以上。但同样一种前体,在细胞的不同生长时期加入,对细胞生长和次生代谢产物合成的作用极不相同,有时甚至还起抑制作用。如在洋紫苏细胞的培养中,一开始就加入色胺,无论对细胞生长和生物碱的合成都起抑制作用,但在培养的第二星期或第三星期加入色胺却能刺激细胞的生长和生物碱的合成。
(7)生长调节剂在细胞生长过程中生长调节剂的种类和数量对次生代谢产物的合成起着十分重要的作用。植物生长调节剂不仅会影响到细胞的生长和分化,而且也会影响到次生代谢产物的合成。生长素和细胞分裂素有使细胞分裂保持一致的作用,不同类型的生长素对次生代谢产物的合成有着不同的影响。生长调节剂对次级代谢的影响随着代谢产物的种类的不同而有很大的变化,对生长调节剂的应用需要非常慎重。
目前,在大规模植物细胞悬浮培养中,为了提高生物量和次生代谢产物量,一般采用二阶段法。第一阶段尽可能快地使细胞量增长,可通过生长培养基来完成。第二阶段是诱发和保持次生代谢旺盛,可通过生产培养基来调节。因此在细胞培养整个过程中,要更换含有不同品种和浓度的植物生长激素和前体的液体培养基。为了获得能适合大规模悬浮培养和生长快速的细胞系,首先要对细胞进行驯化和筛选,把愈伤组织转移到摇瓶中进行液体培养,待细胞增殖后,再把它们转移到琼脂培养基上。经过反复多次驯化筛选得到的细胞株,比未经过驯化、筛选的原始愈伤组织在悬浮培养中生长快得多。
毋庸置疑,在过去几十年中,植物生物技术方面已取得了相当巨大的进展,大大缩短了向工业化迈进的距离。国内有关单位对药用植物,人参、三七、紫草、黄连、薯蓣、芦笋等已展开了大规模的细胞悬浮培养,并对植物细胞培养专用反应器进行研制。国外,培养植物细胞用的反应器已从实验规模1~30L,放大到工业性试验规模130~20000L,如希腊毛地黄转化细胞的培养规模为2m3,烟草细胞培养的规模最大已达到20m3。
值得注意的是影响植物细胞培养物的生物量增长和次生代谢产物积累的因素是错综复杂的,往往一个因素的调整会影响到其他因素的变化,所以,需要在培养过程中不断加以调整,同时,由于不同的植物有机体有自身的特殊性。因此,对于一种植物或一种次生代谢物适合的培养条件,不一定对其他的细胞或次生代谢作用适合。
植物细胞培养是指在离体条件下培养植物细胞的方法。将愈伤组织或其他易分散的组织置于液体培养基中,进行振荡培养,使组织分散成游离的悬浮细胞,通过继代培养使细胞增殖,获得大量的细胞群体。小规模的悬浮培养在培养瓶中进行,大规模者可利用发酵罐生产。
关键词:
阅读原文
分享到:

织梦二维码生成器